The use of probiotics is increasingly popular in preterm neonates, as they may prevent necrotizing enterocolitis (NEC) sepsis and improve growth and feeding tolerance. There is only limited literature on Saccharomyces boulardii CNCM I‐745 (S. boulardii) in preterm infants.
MethodA prospective, randomized, case‐controlled trial with the probiotic S. boulardii (50mg/kg twice daily) was conducted in newborns with a gestational age of 30 to 37 weeks and a birth weight between 1,500 to 2,500g.
Results125 neonates were enrolled; 63 in the treatment and 62 in the control group. Weight gain (16.14±1.96 vs. 10.73±1.77g/kg/day, p<0.05) and formula intake at maximal enteral feeding (128.4±6.7 vs. 112.3±7.2mL/kg/day, p<0.05) were significantly higher in the intervention group. Once enteral feeding was started, the time needed to reach full enteral feeding was significantly shorter in the probiotic group (0.4±0.1 vs. 1.7±0.5 days, p<0.05). There was no significant difference in sepsis. NEC did not occur. No adverse effects related to S. boulardii were observed.
ConclusionProphylactic supplementation of S. boulardii at a dose of 50mg/kg twice a day improved weight gain, improved feeding tolerance, and had no adverse effects in preterm infants>30 weeks old.
O uso de probióticos está cada vez mais popular em neonatos prematuros, já que podem prevenir a enterocolite necrosante (ECN) e a sepse e aumentar o crescimento e a tolerância de alimentação. Há apenas uma literatura limitada sobre a Saccharomyces boulardii CNCM I‐745 (S. boulardii) em neonatos prematuros.
MétodoUm ensaio de caso‐controle prospectivo randomizado com o probiótico S. boulardii (50mg/kg duas vezes por dia) foi feito com recém‐nascidos com idade gestacional de 30 a 37 semanas e peso ao nascer entre 1.500 e 2.500g.
ResultadosForam incluídos 125 neonatos, 63 no grupo de tratamento e 62 no de controle. O ganho de peso (16,14±1,96 em comparação com 10,73±1,77g/kg/dia, p<0,05) e a ingestão de fórmula com nutrição enteral máxima (128,4±6,7 em comparação com 112,3±7,2mL/kg/dia, p<0,05) foram significativamente maiores no grupo de intervenção. Assim que a nutrição enteral foi iniciada, o tempo necessário para atingir a nutrição enteral completa foi significativamente menor no grupo probiótico (0,4±0,1 em comparação com 1,7±0,5 dia, p<0,05). Não houve diferença significativa em sepse. Não ocorreu ECN. Não foi observado efeito colateral relacionado à S. boulardii.
ConclusãoA suplementação profilática de S. boulardii em uma dose de 50mg/kg duas vezes por dia melhorou o ganho de peso, aumentou a tolerância de alimentação e não teve efeito colateral em neonatos prematuros>30 semanas de idade.
A função da barreira gastrointestinal (GI), a motilidade intestinal, a imunidade da mucosa e a capacidade digestiva/de absorção são significativamente subdesenvolvidas no neonato prematuro.1 Os neonatos prematuros apresentam um risco maior de desenvolver crescimento deficiente, infecções hospitalares e enterocolite necrosante (ECN) e de desenvolver uma microbiota intestinal diferente de neonatos amamentados de forma saudável.1,2 Essa está relacionada a uma maior incidência de parto cesáreo, redução da exposição à microbiota materna, aumento da exposição a organismos que colonizam unidades de terapia intensiva neonatais (UTINs), (várias rodadas de) antibióticos e atraso na nutrição enteral.3É debatida uma função dos probióticos no cuidado de recém‐nascidos prematuros. Os probióticos são definidos como “microrganismos vivos que, quando administrados em quantidades adequadas, concedem benefícios à saúde do hospedeiro”.4 Embora os relatos de aumento do crescimento e redução da incidência de ECN sejam animadores, muitos aspectos sobre os mecanismos de ação ainda não são claros.5,6 Os estudos usam diferentes cepas e dosagens, dificultam conclusões baseadas em evidências.5–7
Até agora, os pesquisadores normalmente selecionaram cepas pertencentes a espécies bacterianas naturalmente presentes na flora intestinal, como os lactobacilos ou bifidobactérias.8 A Saccharomyces boulardii CNCM I‐745 (S. boulardii) é uma levedura probiótica isolada da casca de frutas como lichias, produzidas na Indochina.9 A S. boulardii foi mal estudada em neonatos prematuros e com baixo peso ao nascer. O objetivo deste estudo foi avaliar se a S. boulardii administrada em recém‐nascidos prematuros alimentados com fórmulas com menos de 30 semanas de idade gestacional melhoraria o ganho de peso e o resultado clínico.
MétodosInclusão de pacientesNeonatos prematuros estáveis alimentados com fórmula e internados na UTIN do Hospital Shengjing da Universidade de Medicina da China em Shenyang (China) foram incluídos nesse estudo prospectivo duplo‐cego randomizado controlado feito de abril a julho de 2013. O consentimento informado foi obtido dos responsáveis pelos neonatos. O protocolo do estudo foi aprovado pelo Comitê de Ética do Hospital Universitário.
O tamanho da amostra havia sido calculado antes do início do estudo para um nível de significância p<0,05 (bilateral) com uma potência de 80% (β=0,2) para estimar o tamanho da amostra necessário, com desvio padrão de ganho de peso de 9g/dia em ambos os grupos e uma diferença no ganho de peso de 5g/dia entre os dois grupos. Isso resultou em um tamanho da amostra de 125 neonatos, considerando uma taxa de desistência de 20%.
Critérios de inclusão e exclusãoOs critérios de inclusão foram neonatos nascidos no hospital alimentados com fórmula com idade gestacional de 30 a 37 semanas e peso ao nascer entre 1.500 e 2.500g.
Os critérios de exclusão foram patologias neonatais graves, como complicações graves no nascimento, malformações GI, anomalias cromossômicas, imunodeficiência conhecida, hidropsia fetal, cateter venoso central, antifúngicos e probióticos. Todos os pacientes incluídos receberam nutrição parenteral e/ou fórmula para prematuros. Nenhum neonato recebeu leite materno. A nutrição enteral ou trófica mínima foi iniciada assim que possível, com 1mL/kg/dia. A nutrição enteral mínima é a prática de fornecer como alimentação um pequeno volume de alimentos enterais para estimular o desenvolvimento do trato GI imaturo do neonato prematuro; isso melhora a atividade da enzima GI, a liberação de hormônios, o fluxo sanguíneo, a motilidade e a flora microbiana. Os benefícios clínicos incluem melhoria na tolerância ao leite, maior crescimento pós‐natal, redução da sepse sistêmica e menor tempo de internação.10 Assim que a nutrição enteral mínima foi tolerada, o paciente foi aleatoriamente alocado para um de dois grupos à razão de 1/1 (S. boulardii ou grupo de controle). A randomização foi feita de acordo com uma ordem de alocação aleatória determinada por computador e levou em consideração o peso ao nascer. O volume da alimentação foi aumentado quando bem tolerado de acordo com o protocolo local.
IntervençãoO grupo de intervenção recebeu S. boulardii CNCM I‐745, administrada duas vezes por dia como medicação separada, não misturada com a fórmula, a uma dose de 50mg/kg (Bioflor®; CMS Shenzhen Kangzhe Pharmaceutical Co. Ltd., Shenzhen, China, fabricado pela Biocodex, Paris, França); 50mg são cerca de 109 unidades formadoras de colônias (UFC)). A dose do probiótico foi obtida de estudos anteriores em neonatos.11 Nada foi administrado no grupo de controle. O período do estudo se encerrava no 28° dia após o nascimento ou quando o neonato recebia alta hospitalar, caso fosse possível, mais cedo. Contudo, a duração mínima da intervenção era de pelo menos sete dias. Foram coletados dados observacionais e clínicos de rotina de todos os neonatos. O estudo cego foi possível porque a equipe de enfermagem que administrou a S. boulardii aos neonatos não estava envolvida no cuidado diário e a equipe de atendimento neonatal não estava ciente das atribuições de randomização.
ResultadoOs resultados primários foram parâmetros de crescimento de curto prazo: ganho de peso (g/kg/dia) e crescimento linear (cm/semana). Os resultados secundários incluíam: dias de nutrição parenteral necessários para alcançar a nutrição enteral completa, volume tolerado de nutrição enteral máxima (mL/kg/dia) e duração da internação (dias). A intolerância de alimentação foi definida quando o vômito e os resíduos gástricos foram considerados muito importantes. As complicações foram definidas como incidência de ECN (definida como suspeita ou estágio de Bell positivo II ou superior) e sepse (definida como hemocultura positiva).9
Estatísticas – RegistroOs dados foram coletados e incluídos em uma base de dados estatística (SPSS, versão 16.0, IBM, Armonk, EUA). Os dados estão apresentados como média±desvio padrão. Os dados demográficos e variáveis de procedimento foram analisados com o teste t ou teste qui‐quadrado. Foi considerado que um valor de P<0,05 indica uma diferença estatisticamente significativa. Este estudo não foi financiado por fontes externas e foi registrado no website https://clinicaltrials.gov com o número NCT02310425.
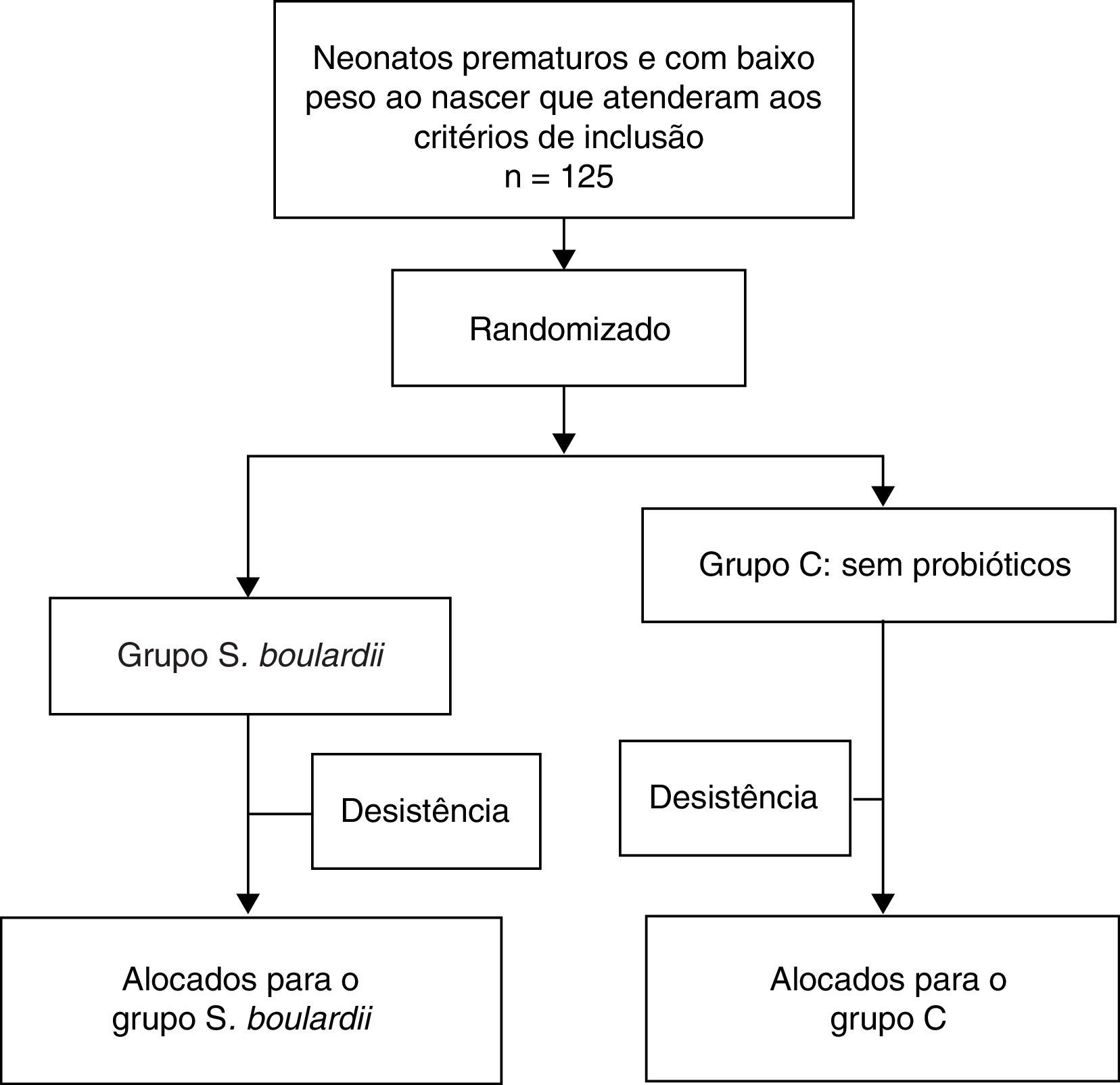
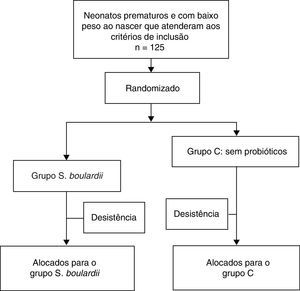
ResultadosDescrição do pacienteForam alimentados com fórmula 125 neonatos prematuros inscritos e aleatoriamente alocados; 63 pacientes receberam S. boulardii assim que puderam tolerar a nutrição enteral mínima e 62 neonatos foram incluídos no grupo de controle; 25 (20%) pacientes foram considerados desistentes (12 (19,1%) no grupo que recebeu S. boulardii e 13 (20,1%) no grupo de controle (fig. 1). Os motivos para desistência foram retirada do consentimento (n=9), perda no acompanhamento (n=11), cateter venoso central (n=1), sífilis congênita (n=1) e inclusões inadequadas (artresia intestinal congênita [n=2], trissomia do cromossomo 21 [n=1]); 51 indivíduos puderam ser analisados no grupo de intervenção e 49 no grupo de controle. As características de todos os neonatos na entrada do estudo estão listadas na tabela 1 e não apresentaram diferença estatisticamente significativa.
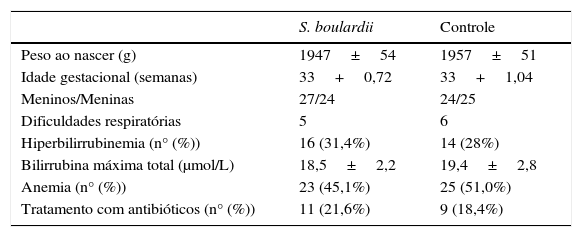
Características (média+1 DP) dos neonatos incluídos
| S. boulardii | Controle | |
|---|---|---|
| Peso ao nascer (g) | 1947±54 | 1957±51 |
| Idade gestacional (semanas) | 33+0,72 | 33+1,04 |
| Meninos/Meninas | 27/24 | 24/25 |
| Dificuldades respiratórias | 5 | 6 |
| Hiperbilirrubinemia (n° (%)) | 16 (31,4%) | 14 (28%) |
| Bilirrubina máxima total (μmol/L) | 18,5±2,2 | 19,4±2,8 |
| Anemia (n° (%)) | 23 (45,1%) | 25 (51,0%) |
| Tratamento com antibióticos (n° (%)) | 11 (21,6%) | 9 (18,4%) |
Dificuldades respiratórias: inclui síndrome do desconforto respiratório e síndrome do pulmão úmido.
S, Saccharomyces; p>0,05 (todos)
A S. boulardii foi administrada pela primeira vez 2,63 dias após o nascimento (intervalo: um a seis dias; em 46 neonatos em três dias, apenas em cinco neonatos entre o dia quatro e o dia seis). O número total de dias de administração de S. boulardii foi, em média, 25,3 dias (intervalo: nove a 28 dias).
Tolerância de alimentaçãoA ingestão de fórmula na nutrição enteral máxima (128,4±6,7 em comparação com 112,3±7,2mL/kg/dia, p<0,05) foi maior no grupo que recebeu S. boulardii do que no grupo de controle e o tempo necessário para atingir a nutrição enteral completa (0,4±0,1 em comparação com 1,7±0,5 dia, p<0,05) foi menor no grupo de intervenção do que no grupo de controle (tabela 2).
Comparação do peso de ganho, crescimento (média+1 DP), tolerância de alimentação, eventos adversos (sepse, sintomas gastrointestinais) e duração da internação entre o S. boulardii e o grupo de controle
| S. boulardii | Controle | P | |
|---|---|---|---|
| Ganho de peso (g/dia) | 16,14±1,96 | 10,73±1,77g | 0,02 |
| Nutrição enteral máxima (mL/kg/dia) | 128,44±6,67 | 112,29±7,24 | 0,03 |
| Quando a nutrição enteral iniciou, tempo necessário até a nutrição enteral completa (dia) | 0,37±0,13 | 1,70±0,45 | <0,01 |
| Aumento da PC (cm/semana) | 0,74±0,03 | 0,72±0,04 | 0,67 |
| Crescimento linear (cm/semana) | 0,89±0,04 | 0,87±0,04 | 0,17 |
| Incidência de sepse (n° (%)) | 4 (7,8%) | 6 (12,2%) | 0,06 |
| Incidência de sintomas GI (n° (%)) | 7/51 (13,7%) | 10/49 (20,4%) | 0,05 |
| Tempo de internação (dias) | 23,3±1,6 | 28,0±1,8 | 0,035 |
PC, perímetro cefálico; GI, sintomas gastrointestinais: regurgitação, vômito, resíduo gástrico; n° (%), número (percentual) de pacientes.
O ganho de peso no grupo que recebeu S. boulardii foi de 16,14±1,96g/kg/dia em comparação com 10,73±1,77g/kg/dia (p<0,05) no grupo de controle. Não houve diferença significativa em crescimento linear, crescimento do perímetro cefálico, incidência de distensão abdominal e incidência de sepse (tabela 2). O tempo de internação do grupo S. boulardii foi mais curto (p=0,035) (tabela 2). Nenhum neonato desenvolveu ECN.
Efeitos adversosNenhum prematuro desenvolveu fungemia. Nenhuma reação adversa à S. boulardii foi relatada.
DiscussãoMostramos que a S. boulardii pode ser administrada com segurança em neonatos prematuros e que melhora a tolerância de alimentação oral e o ganho de peso. Em neonatos a termo, provou‐se que a fórmula complementada com Lactobacillus (L.) rhamnosus GG aumentou o ganho de peso, porém fórmulas complementadas com Bifidobacterium (B.) longum, B. animalis subsp. lactis e L. reuteri não causaram o mesmo efeito.11–13 Em neonatos prematuros, a administração de B. breve também melhorou o ganho de peso.14 Os mecanismos por meio dos quais o ganho de peso é afetado ainda não estão claros.
A S. boulardii é eficaz no tratamento de várias doenças GI relacionadas à presença de patógenos bacterianos e virais.15 Ela compete com patógenos por locais de ligação e produz uma ampla gama de substâncias antimicrobianas.16 A S. boulardii tem capacidade de produzir poliaminas, substâncias essenciais ao crescimento e à diferenciação celular, e de melhorar a maturação, refletida em maiores níveis de expressão enzimática.17 A S. boulardii é uma levedura que aumenta de forma significativa a atividade das enzimas metabólicas na mucosa intestinal, estimula a secreção de enzimas hidrolisantes de dissacarídeos, participa no metabolismo e na absorção de carboidratos e estimula a produção de IgA secretório como resultado de um efeito trófico sobre a mucosa intestinal.18 Além disso, a S. boulardii promove a estabilidade do microbioma intestinal e reduz a possibilidade de má absorção causada por distúrbios GI.19 A translocação da S. boulardii não foi relatada; pelo contrário, foi relatado que a S. boulardii reduz a translocação bacteriana.20 Com base nessas propriedades, trabalhamos com a hipótese de que a S. boulardii pode melhorar o crescimento e os resultados clínicos em neonatos prematuros ou com baixo peso ao nascer.
Apesar de vários ensaios clínicos sugerirem fortemente um lugar para a S. boulardii na prevenção e no tratamento de várias doenças GI em adultos e crianças, os dados em neonatos prematuros são limitados.18 A fórmula suplementada da S. boulardii mostrou‐se bem tolerada por neonatos prematuros e apresentou efeitos benéficos sobre o microbioma GI, tornou‐o parecido com o dos bebês amamentados.11 Os ensaios clínicos em neonatos prematuros também sugeriram que a S. boulardii apresentou melhoria na tolerância de alimentação e reduziu o risco de sepse.21,22 A fim de atingir o crescimento ideal de um prematuro, o objetivo é imitar o crescimento intrauterino ao mesmo tempo em que se obtém um resultado funcional comparável a nascidos a termo.23 Recomenda‐se um ganho de peso de 15 a 20g/kg/dia, de comprimento de 0,7 a 1,0cm/semana e de perímetro cefálico de 0,7cm/semana.24,25 No grupo S. boulardii, o ganho de peso médio foi de 16,14g/kg/dia, crescimento linear de 0,9cm/semana e aumento do perímetro cefálico de 0,7cm/semana, respectivamente. O ganho de peso no grupo de controle foi de 10,73g/kg/dia, abaixo da recomendação. O número de dias para alcançar a nutrição enteral completa foi menor no grupo S. boulardii do que no grupo de controle. O maior ganho de peso provavelmente está relacionado à melhoria da tolerância de alimentação. Observamos que a incidência de vômito, volume de resíduos gástricos e distensão abdominal (“sintomas GI”, tabela 2) diminuíram no grupo de intervenção em comparação com o grupo de controle, embora não houvesse diferença estatística significativa. O tempo de internação total no hospital no grupo S. boulardii foi mais curto do que o do grupo de controle.
Não observamos uma diferença significativa no crescimento linear e na evolução do perímetro cefálico, o que pode estar relacionado ao curto período de intervenção de um mês. Outras limitações deste estudo são a falta de informações sobre características clínicas pós‐natais dos neonatos, que podem ser fatores que influenciam o resultado, como o índice de persistência do canal arterial, hemorragia intraventricular e outros. Faltam informações sobre o número de neonatos com fatores predisponentes para ECN, sepse ou outros problemas como pré‐eclâmpsia, uso pré‐natal de esteroides, ruptura prematura de membranas e parto cesáreo. A ausência de amamentação é outra fragilidade do estudo.
Uma recente revisão Cochrane relatou 24 ensaios clínicos sobre probióticos em neonatos prematuros e concluiu que os ensaios eram altamente variáveis no que diz respeito aos critérios de inclusão (peso ao nascer, idade gestacional), risco básico de ECN, cronograma, dose, formulação dos probióticos e regimes de alimentação.8 A suplementação enteral com probióticos reduziu significativamente a incidência de ECN grave (estágio II ou superior) (risco relativo [RR] típico 0,43, intervalo de confiança [IC] de 95% 0,33 a 0,56; 20 estudos, 5.529 neonatos) e de mortalidade (RR típico de 0,65, IC de 95% 0,52 a 0,81; 17 estudos, 5.112 neonatos).8 De acordo com essa metanálise, não havia evidência de uma redução significativa de sepse hospitalar (RR típico de 0,91, IC de 95% 0,80 a 1,03; 19 estudos, 5.338 neonatos).8 Em nosso ensaio, nenhum prematuro desenvolveu ECN; isso provavelmente está relacionado ao fato de que a idade gestacional para inclusão era de 30‐37 semanas e que o ECN ocorre com mais frequência em neonatos nascidos com uma idade gestacional menor. Ensaios clínicos anteriores mostraram que a suplementação com S. boulardii não reduziu a incidência de óbito nem de ECN em neonatos com muito baixo peso ao nascer, mas melhorou a tolerância de alimentação e reduziu o risco de sepse clínica, ao mesmo tempo em que não foram observados efeitos adversos relacionados à ingestão de S. boulardii.21,22
A S. boulardii teve um efeito protetor contra vários patógenos entéricos por dois mecanismos principais: produção de fatores que neutralizam as toxinas bacterianas e modulação da célula hospedeira, o que sinaliza a via implicada na resposta pró‐inflamatória durante a infecção bacteriana.18,19 Além disso, a S. boulardii pode aumentar a atividade das células T reguladoras e secreção de IgA de células do epitélio e das criptas intestinais e melhorar a proteção intestinal por meio de regulação immune.18 Neste estudo, não houve diferença estatisticamente significativa na incidência de sepse entre os dois grupos (4/51 em comparação com 6/49). Esse achado está de acordo com a análise de Cochrane, mostra que os ensaios clínicos incluídos não relataram infecção sistêmica com o organismo probiótico suplementar.8 A fungemia de S. boulardii foi relatada em pacientes com acesso venoso central.18 Neste ensaio clínico, não houve caso de fungemia e não ocorreu efeito colateral. Os autores da recente revisão Cochrane concluíram que a versão atualizada das evidências disponíveis justifica fortemente uma alteração na prática, o que significa que os probióticos devem ser administrados em neonatos prematuros para diminuir o risco de ECN e mortalidade.8
Em conclusão, os resultados deste estudo mostram que o uso profilático de S. boulardii em neonatos prematuros acelera o ganho de peso e melhora a tolerância de alimentação. Esses dados confirmam uma análise retrospectiva recente que concluiu que os probióticos melhoram a tolerância de alimentação e levam a um crescimento geral melhor em neonatos prematuros.26 Pela primeira vez, sugere‐se maior ganho de peso em neonatos prematuros que receberam S. boulardii. São necessários futuros ensaios clínicos duplo‐cegos controlados por placebo para confirmar esses dados.
Conflitos de interesseY. Vandenplas é consultor da United Pharmaceuticals e da Biocodex. Os demais autores declaram não haver conflitos de interesse.
Como citar este artigo: Xu L, Wang Y, Wang Y, Fu J, Sun M, Mao Z, et al. A double‐blinded randomized trial on growth and feeding tolerance with Saccharomyces boulardii CNCM I‐745 in formula‐fed preterm infants. J Pediatr (Rio J). 2016;92:296–301.